Il nostro corpo è una vera e propria metropoli, e quella del microbioma intestinale è in assoluto la comunità più numerosa e influente. Questo complesso ecosistema di microrganismi svolge un ruolo cruciale in molti aspetti della nostra salute: dalla digestione all’umore, passando per il sistema immunitario.
Ma come fanno questi batteri a sapere dove “parcheggiare” nell’intricato labirinto del nostro intestino? E soprattutto, come possiamo assicurarci che siano i “buoni” a prevalere?
Grazie a un innovativo studio, ora abbiamo una risposta.
Usando una sofisticata tecnica di imaging, i ricercatori hanno identificato i geni che permettono a specifici ceppi batterici di aderire stabilmente a precise nicchie intestinali. Un po’ come trovare il posto auto perfetto in una città caotica. Le implicazioni sono enormi: questa scoperta apre la strada a una nuova generazione di probiotici ultra-precisi e personalizzati. Siete pronti a far entrare il microbioma intestinale nel futuro?
Qui trovate lo studio del Carnegie Science pubblicato sulla rivista Science.
Microbioma intestinale, un micro mondo cruciale per la salute
Negli ultimi anni, come detto, diversi studi hanno collegato alterazioni del microbioma a una vasta gamma di condizioni, dal cancro al seno alla sclerosi multipla, dai livelli di zucchero nel sangue alla personalità. Insomma, se c’è una cosa che abbiamo imparato è che non possiamo più ignorare questi microscopici coinquilini.
Per funzionare al meglio, però, il microbioma intestinale ha bisogno di un delicato equilibrio tra batteri benefici e non proprio. E non solo: ogni specie batterica deve trovare la sua nicchia ecologica, la sua “casa” nell’intricato labirinto dell’intestino. Lo spiega bene William Ludington della Carnegie Institution for Science,
Stiamo parlando di un sistema incredibilmente complesso di comunità microbiche interconnesse, e ogni specie deve arrivare nel posto giusto dove può prosperare e contribuire alla salute dell’ospite.
Una scoperta fondamentale
Il team di Ludington ha sviluppato una tecnica di imaging innovativa che ha permesso di osservare in tempo reale e ad alta risoluzione come una singola cellula di Lactiplantibacillus plantarum, un batterio benefico, colonizza l’intestino di una mosca della frutta.
La scelta della drosophila non è casuale: il suo microbioma è molto più piccolo e definito di quello umano, cosa che lo rende un modello ideale per questo tipo di studi. “Sviluppare questa tecnica di imaging è stata una sfida entusiasmante”, racconta Ren Dodge, co-autore dello studio.
Ci ha permesso di vedere le interazioni delle singole cellule batteriche con l’intestino ospite con un dettaglio senza precedenti.
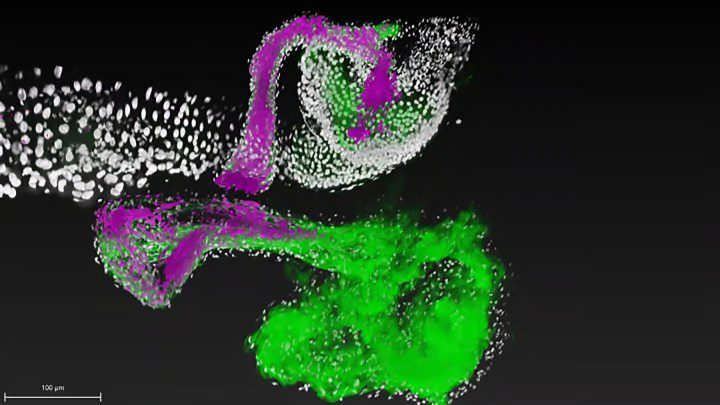
Microbioma intestinale, cosa hanno scoperto?
In sintesi: il successo della colonizzazione dipende da proteine chiamate adesine, presenti sulla superficie dei batteri. Come suggerisce il nome, le adesine permettono ai batteri di “incollarsi” ad altre cellule, tessuti o strutture del corpo.
Ma c’è un problema: di solito le adesine non sono molto selettive su dove aderiscono, e l’attaccamento è transitorio. Invece, utilizzando la loro innovativa tecnica di imaging, i ricercatori hanno osservato che le adesine usate da Lactiplantibacillus plantarum isolato da mosche della frutta selvatiche si attaccavano stabilmente al tessuto intestinale dell’ospite.
Al contrario, il Lactiplantibacillus plantarum di origine umana formava solo un attaccamento di breve durata. Guardando più da vicino, i ricercatori hanno identificato la base genetica per la migliore adesione del batterio all’interno di una specifica nicchia intestinale.
Verso i super-probiotici personalizzati
“Identificando i geni che permettono a L. plantarum di colonizzare nicchie specifiche, ora abbiamo le conoscenze per ingegnerizzare una maggiore precisione in altri batteri”, spiega Kevin Aumiller, co-autore principale dello studio.
Questo apre la porta alla creazione di probiotici ottimizzati per nicchie specifiche nell’intestino umano.
Immaginate: invece dei generici probiotici “taglia unica” attualmente disponibili, in futuro potremmo avere cocktail batterici su misura, con ceppi ingegnerizzati per aderire perfettamente a specifiche regioni del nostro intestino. Un po’ come avere un personal trainer per il nostro microbioma.
Il futuro è batterico
Certo, siamo ancora agli inizi: ci vorrà ancora molta ricerca per tradurre queste scoperte in probiotici di nuova generazione sicuri ed efficaci per gli esseri umani. Il futuro della salute, però, è “segnato” passa per il microbioma intestinale.
Grazie a studi pioneristici come questo, stiamo iniziando a decifrare il complesso linguaggio dei nostri abitanti microscopici. E presto potremmo essere in grado di guidare con precisione i batteri buoni esattamente dove vogliamo, come abili urbanisti del nostro universo interiore.
Quindi, tenetevi pronti: la prossima frontiera della medicina potrebbe essere dentro di noi. E potrebbe avere il sapore di un probiotico ultra-preciso e personalizzato. Il futuro non è mai stato così… batterico.



