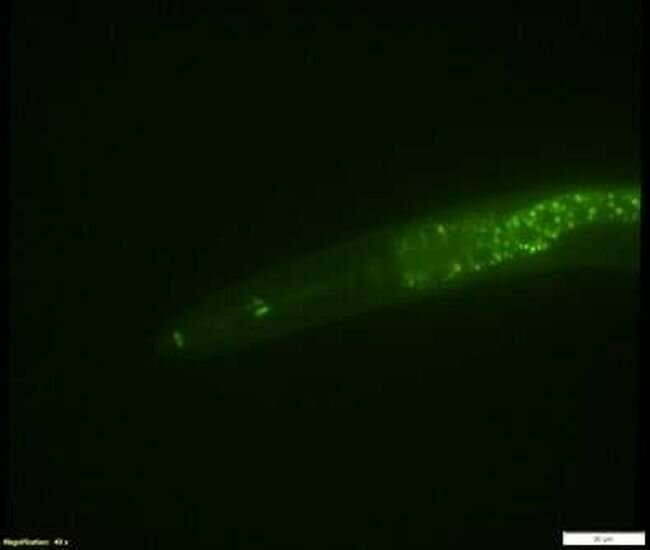
Una nuova tecnica di editing genico scoperta dai ricercatori dell’UO riduce significativamente il tempo dedicato alla ricerca, rendendo possibile l’esplorazione di diverse aree finora non disponibili. Grazie a questo metodo, i biologi possono ora confrontare molte versioni di un gene per trovare mutazioni che danno luogo a tratti specifici, monitorando anche la loro evoluzione nel tempo.
Conducendo questo tipo di ricerca, gli scienziati hanno fatto un passo importante verso l’identificazione di mutazioni rilevanti per la salute umana o la comprensione dei meccanismi alla base delle malattie umane. Sebbene le tecniche di editing genetico di massa siano state già sviluppate per organismi unicellulari come i batteri e il lievito, questa è la prima volta che sono possibili su questa scala in un animale.
L’editing genetico fa un salto in avanti
“In biologia, trascorriamo molto tempo a lavorare con i mutanti genetici. Ma negli animali siamo limitati da quanti mutanti genetici possiamo produrre contemporaneamente”, afferma il ricercatore Zach Stevenson, che ha contribuito a progettare la tecnica. “Questo è un modo nuovo per aggirare quel collo di bottiglia”.
Stevenson e i suoi colleghi descrivono la loro nuova tecnica in un preprint pubblicato su bioRxiv. Ve lo linko qui.
Il sistema, messo a punto col minuscolo verme C. elegans, potrebbe funzionare anche in altri animali da laboratorio, come mosche o topi, dice Stevenson.
Perchè è importante
Ci sono molte ragioni per cui gli scienziati potrebbero volere la capacità di creare molte mutazioni genetiche contemporaneamente. Ad esempio, potrebbero fare editing alla ricerca di una mutazione che rende un animale resistente a un farmaco specifico, o in grado di sopravvivere in determinate condizioni, o meno suscettibile a una malattia.
Potrebbero aver bisogno di esaminare dozzine o addirittura centinaia di possibili variazioni su un gene per trovare quella più efficace.
L’ingegneria di questo tipo di editing genetico sperimentale è estremamente lenta negli animali. Ogni ceppo mutante, un insieme di vermi con una modifica genetica predeterminata, deve essere creato uno per uno. “Di solito,” dice Stevenson, “servono dalle sette alle 10 ore di pratica” per creare un singolo mutante. Questo sistema appena scoperto consente di “crearne decine di migliaia” nel tempo che oggi è necessario per crearne solo tre o quattro.
Come funziona il nuovo metodo
Per accelerare le cose, Stevenson e i suoi colleghi hanno progettato un modo per comprimere centinaia o addirittura migliaia di possibili mutazioni in un’unica “libreria”. Ogni libro in biblioteca è un piccolo frammento di codice genetico, di per sé insignificante e non funzionante. Ogni frammento si inserisce in una “nicchia” ingegnerizzata nel gene che viene preso di mira.,
Questo design permette un vero e proprio cambio di paradigma: invece di iniettare individualmente molti vermi individuali con diverse versioni di un gene, i ricercatori possono iniettare l’intera libreria di mutazioni in un verme.
Quindi, quando il verme si riproduce, la libreria si espande. In ogni prole, un libro dalla libreria delle mutazioni viene selezionato casualmente per completare il gene preso di mira. Il risultato: una collezione di vermi che hanno tutti differenti mutazioni genetiche selezionate casualmente.
I ricercatori hanno chiamato la loro tecnica TARDIS, un giocoso cenno alla cabina della polizia che viaggia nello spazio e nel tempo del Dr. Who. Qui sta per Transgenic Arrays Resulting in Diversity of Integrated Sequences.
Le possibili applicazioni dell’editing 2.0
I ricercatori hanno testato il TARDIS con un gene che conferisce ai vermi resistenza agli antibiotici. Ma vedono ampie applicazioni per la biologia in generale, inclusa la ricerca in altri organismi modello.
Potrebbe essere particolarmente utile per studiare le interazioni tra le proteine o la segnalazione tra le cellule, suggerisce il professore di ricerca dell’UO Stephen Banse, che ha contribuito a sviluppare il TARDIS. Tali interazioni sono spesso rilevanti per la comprensione delle malattie, ma gli scienziati perdono un contesto importante studiandole nel lievito o nei batteri, ha detto Banse.
“Ora possiamo fare queste cose in un modello animale”. E poi nell’uomo.